Исследованы физико-химические и каталитические свойствамоно- и биметаллических катализаторов на основе пентасила и изучены кинетические закономерности алкилирования этилбензола метанолом на оптимальном биметаллцеолитном катализаторе. Вид зависимости селективности по отношению к п-этилтолуолу от конверсии этилбензола позволил предположить, что первичным продуктом алкилирования является именно п-этилтолуол а о- и м- ЭТ образуются в результате изомерзации п-ЭТ. Предложен кинетическая модель алкилирования этилбензола метанолом которая удовлетворительно описывает экспериментальные данные.
Ключевые слова: цеолит типа пентасила, алкилирования, параселективность, метанол, этилбензол, п-, м-, о-,этилтолуолы, кинетика реакции
Этилтолуолы (ЭТ) являются ценными соединениями и широко применяются в нефтехимической и химической промышленности. Например, п-этилтолуол (п-ЭТ) используется в синтезе п- метил стирола, которые имеет преимущество над полистролом, из за его низкой плотности, более высокой температурой стеклования и температурой кипения [1]. Этилтолуолы обычно получают путем алкилирования толуола этанолом или этиленом [2,3]. Чаще всего реакция алкилирования проводится на цеолитах со средними порами, особенно ZSM-5, из- за его формоизбирательных свойства, благоприятствующих параселективность [2,5]. Дальнейшие улучшение параселективности ZSM-5 может быть достигнуто пропиткой каналов цеолита металлическими, неметаллическими оксидами и модификацией внешних кислотных центров. [6–8]
Целю настоящей работы являлось исследование каталитических свойства моно- и биметаллических катализаторов на основе пентасила и изучение кинетических закономерностей алкилирования этилбензола метанолом на оптимальном биметаллцеолитном катализаторе
Экспериментальная часть
Кинетические опыты проводили в проточном реакторе со стационарным слоем катализатора при общем давлении 0,1 Мпа с загрузкой катализатора 0,2–0,5 г при температурах 300, 325 и 3500С. Реактор представлял собой трубку из кварца диаметром 1,5 см и длиной 15 см снабженную электронагревателем. Катализатор восстанавливали водородом, подаваемым со скоростью 40 мл/мин, при 5000 С в течение 3 ч. Перед загрузкой в реакторе катализатор смешивали с инертной керамической насадкой. Смесь этилбензола и метанола нагревали до 1200 С и подавали в реактор вместе с газом носителем. Газом носителем служил водород. Мольное отношение этилбензол:метанол: Н2 составляло 2:1:3. Предварительные опыты показали, что катализатор сохраняет активность в алкилировании этилбензола метанолом в течение 30 ч. Специальными опытами при постоянном эффективном времени контакта W/FЭБ, гкат·ч/моль (W-масса катализатора, г; FЭБ- скорость подачи ЭБ, моль/г) и варьировании скорости подачи потока и размера частиц катализатора было доказано отсутствие внешних и внутренних (в макропорах) диффузионных ограничений скорости реакции.
Результаты иих обсуждение
На рис 1. показано влияние продолжительности работы на показатели алкилирования этилбензола метанолом в присутствии моно и биметаллических катализаторов на основе цеолита типа ЦВМ. Видно, что при продолжительности работы 2–10 ч катализаторы не теряют первоначальную активность. Однако биметаллический катализатор состава In-La-P-HЦВМ проявляют более высокую параселективность, чем монометаллический катализатор La-P-HЦВМ.
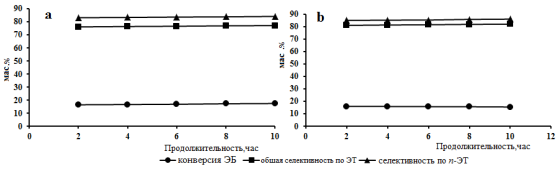
Рис 1. Влияние продолжительности работы моно(а) и биметаллических (b)катализаторов в реакции алкилирования ЭБ метанолом (: T=3500C, v=2.0 ч-1, ЭБ:метанол=2:1, H2/ЭБ=2:1. a — 4 % La 3 % P-H-ЦВМ; b — 0.6 % In 4 %La3 % P-H-ЦВМ
При температуре реакции 3500 С селективность по п-ЭТ на биметаллическом катализаторе достигает 86,5 %. На монометаллическом катализаторе селективность по п-ЭТ существенно ниже и составляет 77,6 %. В связи с тем что, модифицированные пентасилы являются перспективными катализаторами парофазного алкилирования этилбензола метанолом с целью выяснения количественных закономерностей процесса нами изучена кинетика реакции алкилирования этилбензола метанолом на биметаллическом катализаторе In-La-P-HЦВМ.
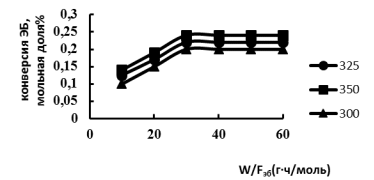
Рис. 2. Зависимость конверсии этилбензола от эффективного времени контакта W/FЭB при различных температурах; 1–300; 2–325; 3–350° С
Как видно из рис.2, в интервале температур 300–3500С с увеличением времени контакта до 30 гч/моль наблюдается рост конверсии этилбензола. При дальнейшем увеличении времени контакта конверсия этилбензола остается практически постоянной. Поэтому изучение кинетических закономерностей реакции алкилирования проводили в интервале температур 300–3500С при постоянном эффективном времени контакта W/F равном 30 гч/моль. Теоретически первичными продуктами алкилирования этилбензола могут быть п- и о-этилтолуолы. Однако вид зависимости селективности по отношению к п-этилтолуолу от конверсии этилбензола (рис.2) позволяет предположить, что первичным продуктом алкилирования является именно п-этилтолуол а о- и м- ЭТ образуются в результате изомерзации п-ЭТ
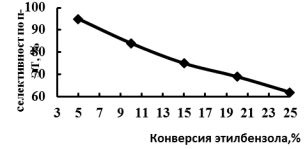
Рис. 3. Зависимость селективности по п- ЭТ от конверсии этилбензола
При изомеризации п-ЭТ образуется смесь трёх изомеров этилтолуолов (п-ЭТ, м-ЭТ, о-ЭТ). Механизм алкилирования этилбензола метанолом можно представить по следующей схеме:
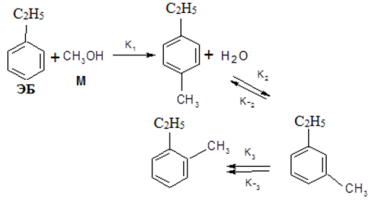
Основываясь на двухцентровом механизме Ленгмюра- Хиншельвуда можно получить следующие уравнения скоростей стадий:
rM= r1 = K1·KЭБ·KM·PЭБ·PM/Z2 (1)
rp-ЭT= [K1·KЭБ·KM·PЭБ·PM ̶ K2(Kп-ET ·Pп-ЭT — Kм-ЭT·Pм-ЭT)] z2 (2)
rм-ЭT = [k2 (Kп-ЭT Pп-ET — Kм-ЭT·Pм-ЭT/K2) — K3 (Kм-ЭT ·Pм-ЭT — Ko-ЭT·Po-ЭT)] z2 (3)
ro-ЭT = [K3·(Kм-ЭT·PЭ-ET — Ko-ЭT·Pм-ЭT)/ K3] z2 (4),
z = 1+ KЭБ·PЭБ + Kм·Pм + Kм-ЭT·Pм-ЭT + Ko-ЭT·Po-ЭT + Kп-ЭT Pp-ЭT
i — ЭБ, М, п-ЭТ, м-ЭТ, о-ЭТ — индексы, обозначающие соответственно: этилбнзол, метанол, п-, м-, и о-этилтолуолы;
Кi- константа скорости адсорбции и десорбции i–го компонента,
Рi- парциальное давление i-го компонента, кПа,
К2 и К3 — константы равновесия, определяемые из уравнений:
К2 =К2 /К -2 К3 =К3 /К-3.
Неизвестные кинетические параметры уравнений 1–4 и константы адсорбции определяем методом нелинейной регрессии. Численное интегрирование уравнений 1–4 проводили по программе Рунге-Кутта четвертого порядка с фактором оптимизации:
Ф= 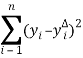 где,n — число точек;
где,n — число точек;![]() — экспериментальная и расчётная конверсия соответственно. Из таблицы следует, что алкилирование этилбензола протекает медленнее (72,36 кДж/моль), чем изомеризация этилтолуолов (27,24 и 42,37 кДж/моль). Исходя из значений энергии активации стадий можно сделать вывод, что образование п- и о-этилтолуолов протекает в режиме, переходном от диффузионного к кинетическому.
— экспериментальная и расчётная конверсия соответственно. Из таблицы следует, что алкилирование этилбензола протекает медленнее (72,36 кДж/моль), чем изомеризация этилтолуолов (27,24 и 42,37 кДж/моль). Исходя из значений энергии активации стадий можно сделать вывод, что образование п- и о-этилтолуолов протекает в режиме, переходном от диффузионного к кинетическому.
Расчетные величины энергий активаций и предэкспоненциальных множителей для стадий реакции алкилирования этилбензол метанолом
|
Константы скорости |
Энергия активации, кДж/моль |
Предэкспоненциальныймножитель |
|
K1 |
72.36±5.33 |
3.16·106 |
|
K2 |
27.24±2.72 |
8.8·10 |
|
K3 |
42.37±3.24 |
2.6·103 |
|
KЭБ |
-37.63±3.36 |
1.68·10–4 |
|
Kм |
-25.26±2.17 |
5.32·10–3 |
|
Kп-ЭТ |
-24.83±1.66 |
4.29·10–2 |
|
Kм-ЭТ |
-22.12±1.27 |
3.18·10–1 |
|
Ko-ЭТ |
-16.17±1.73 |
2.137 |
Расчетные и экспериментальные значения конверсии этилбензола хорошо согласуются между собой. Это значит, что предложенная кинетическая модель удовлетворительно описывает экспериментальные данные.
Литература:
- Kaeding W. W., Young L. B. Para-methylstyrene //Chem.Technol, 1982, V. 12, № 9, p.556–560.
- Bhandarkara V., S. Bratia. Selektive formation of ethyltoluene by alkylation with ethanol over modified HZSM-5 zeolites // J.Catalysis -1994. — V.14. — P. 439–449.
- Walendziewski J., Trawezynski Alkylation of toluene with ethane // Jnd. Eng. Chem. Res. 1996, V.35. P.3356
- Xinxin G., Na Li, Guangjum Wn., Juxin Ch. Para-selectivity of modified HZSM-5 zeolites bu nitridation for ethylation of ethylbenzene with ethanol // J.molekular catalysis, 2006, v.248, p.220–225.
- Joseph R., Antony K. Ethylation and disproportionationation of ethylbenzene over subetitutied AFI type molecular siwes // J.Mol.Catal., 2007, v.270, № 1–2, p.195–200.
- Алиев И. А. Ахмедов Э. И. Мамедов Э. С. Гахраманов Т. О. Влияние содержания фосфора на физико-химические и каталитические свойства Н-ультрасила в реакции этилирования толуола. //Журнал прикладной химии. 2009, Т.82, 3, с.518–520.
- Алиев И. А., Гахраманов Т. О., Мамедов Э. С., Ахмедов Э. И. Этилирование толуола этанолом на высококремнеземном цеолите, модифицированном кадмием. // Нефтехимия, 2010, т.50, № 5, с.1–3.
- Ogunbadego B. A., Osman M., Arudra P., Aitani A., Al-Khattaf S. Alkylation of toluene with ethanol tonpara-ethyltoluene over MFI zeolites//Catal.Today. 2015, v.243, p.109–117.

