Наличие в молекуле многих природных и синтетических соединений пирролидинового цикла обуславливает широкий спектр их биологической активности.Известно, что пирролидин-2-оновый фрагмент является фармокофорной группой ряда ноотропных препаратов (пирацетам, оксицерам, фенотропил), а синтез и изучение свойств соединений, содержащих пирролидин-2-оновый фрагмент, представляет значительный научный и практический интерес.
Среди многочисленных методов синтеза гетероциклических соединений реакциям циклоприсоединения принадлежит одно из ведущих мест. В частности, простым и удобным методом построения пятичленных гетероциклических систем с двумя стоящими рядом атомами азота — пиразолинов является 1,3-диполярное циклоприсоединение диазосоединений к С=С-связи алкенов [1, с. 1057–1062].
С целью получения новых производных пирролидин-2-онов с использованием методологии 1,3-дициклоприсоединения диазосоединений к электронно-дефицитным алкенам был получен метиловый эфир 4-(n-метоксифенил)-пиразолин-3 карбоновой кислоты — предшественник 4-арилзамещенного 3-аминпирролидона.
Синтез исвойства -диазоамидов.
В настоящее время большее число публикаций в литературе относится к синтезу и свойствам линейных диазоамидов [2, с. 1091–1160], повышенный интерес к которым обусловлен их уникальной реакционной способностью.
Среди циклических диазоамидов наиболее изучены синтез и свойства диазопеницилланатов и диазоцефалоспоронатов — относящихся к β-диазолактамам. Однако в последние годы всё чаще объектом исследований становятся синтетические возможности γ-диазолактамов [3, с. 42–45]. Данные о синтезе и свойствах других диазолактамов немногочисленны и разрознены [4, с. 11035–11043].
Свойства диазоамидов определяются наличием трех функциональных групп находящихся в α-положении С=O, C-N и С=N2. Характерными реакциями диазоамидов, обусловленными наличием диазогруппы являются реакции изомеризации, 1,3-диполярного присоединения, каталитического и фотохимического внедрения, [2+1]-циклоприсоединения.
В работах [5, с. 1069–1074] показано, что сходные к диазопирролидонам диазопиразолиноны 1, 2 и 3 вступают в реакции 1,3-диполярного присоединения к электронодефицитным алкенам. Судьба образующихся спиропиразолов во многом определяется природой заместителей и включает ароматизацию путем термически разрешенной 1,5-ацильной миграции (перегруппировка Ван-Альфена — Хюттеля) с образованием пиразолотриазинонов 4b-hи 5a,b, либо раскрытие цикла, ведущее к ациклическому диазоалкану, который при этих условиях быстро отщепляет азот и дает соответствующие фуропиразолы 6b,c [6, с. 5969–5978].
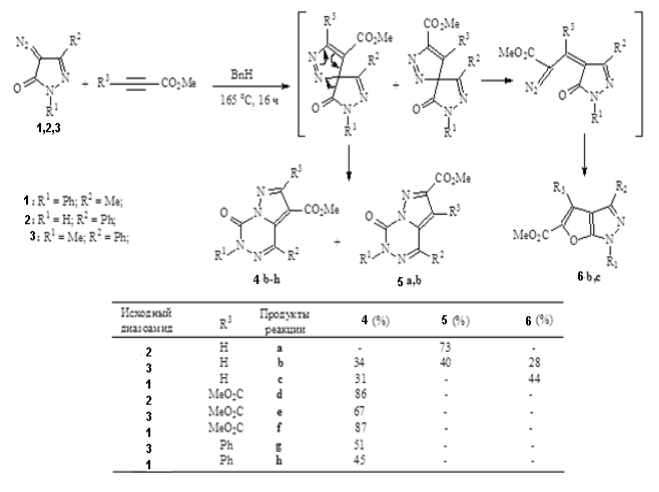
Рис. 1.
При взаимодействии диазопиразолинонов 1 и 3 с метилакрилатом в кипящем толуоле с высоким выходом были получены соответствующие спироциклопропаны 7 a, b.
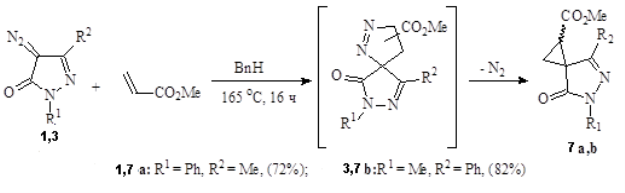
Рис. 2.
Получение метилового эфира пара- метокси коричной кислоты.
В круглодонную колбу емкостью 100 мл поместили раствор 3 г n-метоксибензальдегида, 2 г малоновой кислоты и 40 мл свежеперегнанного пиридина. Добавили две капель пиперидина и кипитли смесь в течение 2 часов с обратным холодильником. После охлаждения прилили 20 мл воды и подкислили разбавленной соляной кислотой до кислой реакции. Отфильтровывали выпавшую n-метоксикоричную кислоту на воронке Бюхнера и перекристаллизовывали из 50 %-го этилового спирта. Малоновую кислоту нужно хорошо растворить с повышением температуры. За ходом реакции следили по ТСХ. Выход 72 %.
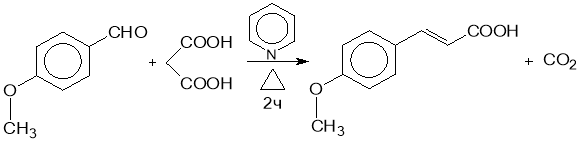
Выход кислоты несколько увеличивается, если вместо кипячения нагревать реакционную смесь в течение 2х часов на кипящей водяной бане, и только затем на краткое время (10 мин) довести до кипения; и дать остыть до комнатной температуры. Структуру соединения определяли по спектрам ИК и ЯМР 1H, 13С и 15N.
Синтез метилового эфира 4-(n-метоксифенил)-пиразолин-3 карбоновой кислоты.
К раствору 2,91 г (1 моль) пара-метоксикоричной кислоты в 20 мл диэтилового эфира, при постоянном перемешивании и температуре -50С прикапывали в течение 1 ч. 20 мл 0.5 М эфирного раствора СH2N2 (5 моль). Затем реакционную смесь нагрели до комнатной температуры и оставили на 72 ч. Растворитель удалили при пониженном давлении, остаток сушили в вакууме до постоянной массы.
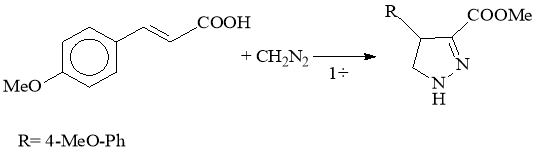
Получили 0,8123 г (81 %) метилового эфира 4-(n-метоксифенил)-пиразолин-3 карбоновой кислоты в виде желтовато-белого кристалла с т. пл. 115-120°С. Структуру соединения определяли по спектрам ИК и ЯМР 1H, 13С и 15N.
Спектры ЯМР 1H, 13С и 15N были регистрированы на спектрометрах BrukerAM-300 (300.13 и 75.47 МГц соответственно) и Bruker Avance III (500, 126 и 51 МГц соответственно), внутренний стандарт — Me4Si. ИК-спектры записаны на приборе IRPrestige–21 Shimadzu в тонком слое или вазелиновом масле.
Тонкослойную хроматографию проводили на пластинках TLCSilucagel 60 F254 фирмы «Merck» при проявлении в йодной камере.
Выводы.
- Получен метиловый эфир пара-метоксикоричной кислоты. Проведена очистка продукта реакции методом перекристаллизации.
- Осуществлен синтез пирозолинкарбоксилата реакцией взаимодействия метилового эфира пара-метоксикоричной кислоты с диазометаном.
- Наработана опытная партия метилового эфира 4-(n-метоксифенил)-пиразолин-3 карбоновой кислоты и отдана на испытания для первичного скрининга.
Литература:
- Томилов Ю. В., Шулишов Е. В., Нефедов О. М. Взаимодействие диазоалканов с непредельными соединениями. Сообщение 10. 1,3-Диполярное циклоприсоединение диазоциклопропана к напряженным циклоалкенам. // Изв. АН СССР, Сер. хим. — 1991. — № 5 — С. 1057–1062.
- T. Ye, M. A. McKervey. Organic Synthesis with б-diazocarbonyl compounds. // Chem. Rev. — 1994. — Vol. 94. — № 4. — P. 1091–1160.
- Z.-Y. Cao, F. Zhou, Y.-H. Yu, J. Zhou. A highly diastereo- and enantioselective Hg(II)-catalyzed cyclopropanation of diazooxindoles and alkenes. // Org. Lett. — 2013. — Vol. 15. — №. 1. — P. 42–45.
- A. DeAngelis, O. Dmitrenko, J. M. Fox. Rh-Catalysed intermolecular reactions of cyclic б-diazocarbonyl compounds with selectivity over tertiary CH-bond migration. // JACS. — 2012. — Vol. 134. — № 26. — P. 11035–11043.
- A. Padwa, A. D. Woolhouse, J. J. Blount. 1,3-Dipolar cycloaddition reactions of diazopyrazolinones with electron-deficient dipolarophiles. // J. Org. Chem. — 1983. — Vol. 48. — № 7. — P. 1069–1074.
- Z. Zhang X., Wang S., Tao S., Zhu. 1,3-Dipolar cycloaddition reaction of 3-trifluoromethyl-4-dyazopyrazolinones with acetylenedicarboxylates. // Tetrahedron. — 2012. — Vol. 68. — № 30. — P. 5969–5978.

