Annually, at least 1.5 million people die worldwide from various injuries [11, 12]. According to WHO estimates, approximately 80 million accidents occur in Europe each year, with an average trauma incidence rate of 2200 injuries per day (90 cases per hour). Polytrauma holds a specific place within the structure of injuries. It is one of the three leading causes of mortality in the population [8, 12] and represents the maximum degree of stress, causing a breakdown of adaptation mechanisms that lead to alterations in rehabilitation processes, unlike isolated injuries.
«Mutual Aggravation Syndrome» (MAS) is the interaction of pathophysiological processes in polytrauma, presenting a cumulative threat from all injuries. Its manifestation is a more severe course of the pathological process, which increases the frequency of complications and lethal outcomes due to impairments in the functioning of the CNS, the pituitary-adrenal, cardiovascular, respiratory, and other systems, as well as disturbances in all types of metabolism. The most frequent manifestation of MAS is the combination of traumatic brain injury (TBI) and musculoskeletal trauma, as well as fat embolism syndrome (FES) — a severe, life-threatening condition, an early manifestation of traumatic disease or one occurring some time after surgical intervention related to polytrauma correction [4, 7, 15, 16, 20].
Traumatic fat embolism syndrome (FES) is a severe early complication of polytrauma, arising against a background of shock caused by blood loss, decreased circulating blood volume, and microcirculation disturbances. Shock is a universal adaptation mechanism leading to perfusion changes in the CNS, becoming a cause of secondary brain damage, development of hemorrhagic and ischemic processes, which determine serious hypoxic changes in all organs and tissues [1, 4, 10, 13, 14, 17, 18, 19].
To date, there are no combined, highly informative methods for the early diagnosis of polytrauma complications. The search for new methods of visual diagnosis of FES and cognitive post-traumatic brain disorders is highly relevant. A clinical case is presented, assessing cognitive function using the Montreal Cognitive Assessment (MoCA) and visual diagnosis of FES using a non-invasive technique of bilateral transcranial Doppler monitoring of flow in the middle cerebral arteries with microembolus detection on an ultrasound transcranial Doppler analyzer in a 20-year-old patient after polytrauma from a motor vehicle accident and correction of the left lower limb injury by applying an external fixation device.
Keywords: polytrauma, traumatic fat embolism syndrome, cognitive impairment screening (Montreal Cognitive Assessment (MoCA)), bilateral transcranial Doppler monitoring with microembolus detection (MES) in the middle cerebral arteries (MCA).
Сочетанная травма (СТ) — одна из превалирующих проблем современного общества [1, 11, 12]. Данный вид травмы наиболее часто возникает вследствие дорожно-транспортных происшествий [12]. В числе причин смертности и инвалидизации населения она выходит на первое место в ряде развитых и развивающихся стран, что делает ее проблемой не только медицинской, но и социально-экономической [1, 8, 12]. СТ представляет собой максимальную степень стресса, обуславливающую срыв механизмов жизнеобеспечения. Сегодня мы говорим о «синдроме взаимного отягощения» (СВО), указывающем на более тяжелое течение патологического процесса [12,13, 17].
Среди особенностей течения травматической болезни при СТ можно выделить три основных патогенетических фактора: а) одновременное возникновение нескольких очагов ноцицептивной патологической импульсации, что при достаточно длительном и интенсивном воздействии приводит к дезинтеграции и срыву срочных компенсаторных механизмов, следовательно, усилению тяжести и резистентности травматического шока; б) одновременное существование нескольких источников наружного и внутреннего кровотечения, что обуславливает сложность определения общего объема кровопотери; в) возникновение и усугубление раннего посттравматического эндотоксикоза, который приобретает большую значимость при повреждении обширных массивов мягких тканей и внутренних органов [11,12]. СТ чаще диагностируется в случаях, когда механическое воздействие вызывает одновременно и внутричерепные и внечерепные повреждения, ас учетом локализации внечерепных повреждений СТ подразделяется на травму [12]: а) с повреждением лицевого скелета; б) с повреждением грудной клетки и ее органов; в) с повреждение органов брюшной полости и забрюшинного пространства; г) с повреждением позвоночника и спинного мозга; д) с повреждением конечностей и таза; ж) с множественными внутренними повреждениями. Синдром взаимного отягощения, наблюдаемый при СТ, меняет течение травматической болезни и играет фатальную роль в формировании ранних и поздних осложнений. Наиболее частым проявлением СВО является сочетание ЧМТ и повреждений опорно-двигательного аппарата (ОДА). Повреждение ЦНС в структуре СТ может привести к развитию состояния, являющегося классической постагрессивной реакцией (SIRS-CARS-CHAOS). Она включает системную воспалительную реакцию, органные изменения и эндотелиальную дисфункцию. При повреждении ЦНС наблюдается перерыв структурных связей (характерно для сотрясения ГМ) или нейронное торможение (при очаговой ишемии).
Изучение процессов СВО вызывают больший интерес, особенно после внедрения системы «damage control» (система контроля повреждений, предложенной Ганноверской школой политравмы в 1990 г.), суть которой заключается в расчленении оперативного лечения повреждений внутренних органов и опорно-двигательного аппарата на два этапа: в первые сутки выполняют минимальные жизнеспасающие непродолжительные операции (при переломах крупных костей конечностей, иммобилизация аппаратом наружной фиксации), затем интенсивная терапия до полной стабилизации гемодинамических и других показателей гомеостаза, а через 3–5-7 суток — малоинвазивный остеосинтез переломов длинных костей, с целью улучшения исходов при политравмах [2, 12, 13, 14, 15,17,18. 19].
Нередко у пациентов, переживших автодорожную травму, развивается посттравматическая и психопатологическая симптоматика [3, 11, 12]. Травма — событие, связанное с мощным психотравмирующим воздействием и сопровождающимся стрессом экстремального характера — совокупностью неспецифических адаптационных реакций организма на воздействие различных неблагоприятных факторов-стрессоров (физических или психологических), нарушающее его гомеостаз, а также соответствующее состояние нервной системы организма либо организма в целом [3, 8, 9, 12].
По определению ряда авторов, жировая эмболия (fat embolis syndrome –ЖЭ) — это множественная окклюзия кровеносных сосудов каплями жира (жировыми эмболами), недифференцированными липидными массами, липидными комплексами, жировыми клетками размером не превышающим 6–8 мкм [4, 5, 6, 7]. Это патологическое состояние, одно из осложнений СТ, выступающее в качестве причины летальных исходов на ранних стадиях травматической болезни [4, 5, 7, 10].
Нередко СТЖЭ протекает под маской пневмонии, респираторного дистресс-синдрома взрослых, черепно-мозговой травмы и другой патологии, что способствует значительному росту летальности. Для диагностики этого синдрома чаще используют критерии Gurd and Wilson, включающих 3 «больших» (острая дыхательная недостаточность (ОДН), энцефалопатия, петехиальная сыпь) и 8 «малых» (тахикардия, лихорадка, изменения сетчатки глаза (жировые микроэмболы), показателей крови (тромбоцитопения, анемия, повышение СОЭ) и моче (олиго/анурия, наличие капель жира), капли жира в мокроте) критериев [4, 6, 7, 10]. Простыми неинвазивными методами ранней диагностики жировой эмболии являются флуоресцентная микроскопия крови на жир, рентгенография легких, ЭКГ и исследование глазного дна, однако большие трудности вызывает диагностика ЖЭ у пациентов в бессознательном состоянии, когда возникает необходимость в проведении дифференциальной диагностики между травматическим шоком 3–4 степени, тяжелой черепно-мозговой травмой (ЧМТ) и жировой эмболией [4, 5, 7,10].
До сих пор остается недостаточно изученным синдром взаимного отягощения, наблюдаемый при СТ, на основании комбинированного скрининга оценки когнитивных функций (Монреальская когнитивная шкала (MoCA)) и обнаружения микроэмбол в сосудах головного мозга (критерий СТЖЭ) на основе неинвазивных ультразвуковых допплеровских методик.
Результаты и обсуждение
Пациент К., 20 лет, доставлен бригадой скорой медицинской помощи, в приемное отделение ГБУЗ КГКБ № 11 г. Кемерово после ДТП и оказания первой помощь на месте происшествия (транспортная иммобилизация и обезболивание). Сразу при поступлении в приемный покой осмотрен врачом травматологом, с верификацией диагноза: Автодорожная травма. Закрытий оскольчатый перелом средней трети левой бедренной кости со смещением отломков. Закрытый перелом анатомической шейки правой плечевой кости с отрывом большого бугорка и со смещением отломков. Ушиб и ссадины мягких тканей лица. Ушиб мягких тканей головы. Травматический шок.
С целью выбора тактики дальнейшего ведения и лечения, пациенту был выполнены ряд диагностические исследования, включающий лучевые методы диагностики: компьютерная томография головного мозга (КТ ГМ); рентгенография (R-графия) органов грудной клетки и костей таза; ультразвуковое исследование (УИ) органов брюшной полости и почек, по результатам которых патологических изменений и повреждений исследуемых органов установлено не было. Однако, по результатам R-графии плечевого сустава и бедренной кости диагностированы перелом правой плечевой кости со смещением и перелом левой бедренной кости со смещением. Лабораторные показатели крови (Hb-140 г/л, Ht- 40,6 %, Plt- 330х10 9 /л) в пределах референсных значений.
Принимая во внимание результаты лабораторно-инструментальных методов исследования врачом травматологом было принято решение о проведении хирургического лечения диагностированных повреждений в несколько этапов, на первом этапе которого было решено выполнить наложение аппарат внешней фиксации на левую нижнюю конечность. Перед транспортировкой в операционную пациент был осмотрен врачом анестезиологом, который оценил состояние, как средней степени тяжести, по шкале комы Глазго — 15 баллов (в сознании, доступен продуктивному контакту); дыхание спонтанное через естественные дыхательные пути (сатурация SpO2–97 % на атмосферном воздухе); гемодинамика с тенденцией к гипертензии (уровень АД — 140/90 мм.рт.ст.) и тахикардии (Ps — 106 уд/мин.). Перед операцией был проведен скрининг когнитивных нарушений с использованием Монреальской когнитивной шкалы (MoCA) с рядом параметров, оцениваемых в баллах: кратковременная память и вспоминание; пространственно-зрительные способности; множественные аспекты исполнительных функций; внимание, концентрация и рабочая память; языковые функции; абстрактное мышление; ориентация во времени и пространстве, которая свидетельствовала о наличии у пациента легких когнитивных нарушениях (22 балла). В условиях операционной, под внутривенной анестезией было выполнено наложение аппарата внешней фиксации на левую нижнюю конечность, с дальнейшим переводом в отделение травматологии.
Спустя трое суток (72 часа), после предварительной предоперационной подготовки, в соответствии с системой «damage control» (система контроля повреждений, предложенной Ганноверской школой политравмы в 1990 г.), пациент был вновь взят в операционную, где под эндотрахеальной (интубационной) анестезией был выполнен второй этап хирургического лечения травмы правой плечевой кости с удалением свободно лежащих фрагментов головки плечевой кости и косыночной иммобилизацией правой верхней конечности, а также открытая репарация и надкостный остеосинтез дистальной трети левой бедренной кости титановой пластиной с винтами.
Во время выполнения второго этапа хирургического лечения с целью изучения церебральной эмболии, клинической и прогностической значимости регистрации микроэмболических сигналов, в том числе липидов (критерий ТСЖЭ), у пациентов с СТ, как интраоперационно, так и в раннем послеоперационном периоде, для верификации источников эмболии и определения объективных, а также субъективных критериев эмбологенности, было проведено билатеральное мониторирование кровотока в средних мозговых артериях с микроэмболодетекцией , метода, позволяющего диагностировать наличие микроэмбол в потоке крови артерий, кровоснабжающих головной мозг.
На основании сопоставления результатов транскраниального допплеровского мониторирования с выраженностью неврологической симптоматики в интра- и послеоперационном периоде, было решено оценить клиническую и прогностическую значимость регистрации микроэмболических сигналов, как раннего критерия развития ТСЖЭ.
Исследование проводилось на ультразвуковом транскраниальном допплеровском анализаторе Ангиодин (Биосс, Россия) импульсно-волновыми датчиками с частотой 2 МГц, фиксированными на шлеме Спенсера, позволяющем определить в допплеровском спектре дистального кровотока наличие атипичных сигналов, имеющих характерные ультразвуковые допплеровские признаки.
Локация СМА (средние мозговые артерии) одновременно с двух сторон выполнялась через височное акустическое «окно» (лоцированы правая и левая СМА на глубине 59 мм) на протяжении 210 минут в положение пациента лежа, с использованием минимальных уровней усиления и мощности, обеспечивающих сохранность допплеровского спектра и минимизацию артефактов. Идентификация микроэмболосигналов (МЭС — микроэмболодетекция) во время мониторирования осуществлялась автоматически, с последующим анализом результатов и дифференцировкой МЭС от артефактов с использованием критериев дифференцировки (эмбола/артефакт). В случаях обнаружения микроэмбол регистрация проводилась с оценкой их интенсивности (учет количества МЭС/час), частоты (Гц), мощности (дБ), длительности (мс) каждого, с дальнейшей математической обработкой полученной информации путем вычисления энергетических индексов (ЭИ) МЭД, по формуле представляющих собой произведение мощности сигнала (дБ) на его длительность (мс)-ЭИ (Дж*10–3).
Интраоперационно в момент выполнения хирургической коррекции травматического повреждения правой верхней конечности (удаление свободно лежащих фрагментов головки правой плечевой кости и косыночной иммобилизацией) зарегистрировано 19 микроэмболических сигналов (МЭС) по правой СМА с частотой 500 до 1000 Гц, тогда, как при оперативном лечении левой нижней конечности (открытая репарация и надкостный остеосинтез дистальной трети левой бедренной кости титановой пластиной с винтами), зарегистрировано 174 сигнала по той же мозговой артерии, с такой же частотой (рис. 1, 2.).
После завершения второго этапа хирургического лечения, в соответствии с системой «damage control», пациент был переведен в отделение реанимации для проведения интенсивной терапии и реабилитационных мероприятий, с учетом выявленных нарушений.
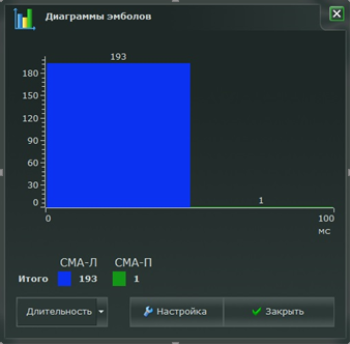
Рис. 1. Регистрация микроэмболических сигналов с частотой 500–1000 Гц при проведении билатерального транскраниального допплеровского мониторирования с МЭС на анализаторе Ангиодин (Биосс, Россия) у пациента К., 30 лет, интраоперационно
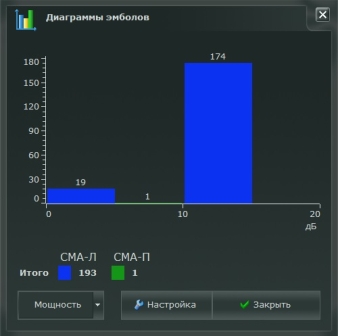
Рис. 2. Количество зарегистрированных микроэмболических сигналов с частотой 500–1000 Гц при проведении билатерального транскраниального допплеровского мониторирования с МЭС на анализаторе Ангиодин (Биосс, Россия) у пациента К., 30 лет, интраоперационно
Спустя сутки после второго этапа оперативного лечения (24 часа), в условиях отделения реанимации и интенсивной терапии, было выполнено контрольное билатеральное транскраниальное допплеровское мониторирование с микроэмболодетекцией в СМА, через височный акустический доступ с лоцированием СМА справа и лева на глубине 55 мм, в результате которого не было зарегистрировано наличие микроэмболических сигналов.
Далее, для дальнейшего лечения и реабилитации пациент был переведен в специализированное травматологическое отделение, на базе которого, был проведен контрольный скрининг когнитивных изменений с использованием Монреальской когнитивной шкалы (MoCA), который не установил наличия когнитивных нарушений (27 баллов — норма) перед выпиской из стационара.
Выводы: таким образом, комбинированный скрининг когнитивных изменений с использованием Монреальской когнитивной шкалы (MoCA) и метода билатерального транскраниального допплеровского мониторирования потоков в средних мозговых артериях (СМА) с микроэмболодетекцией (МЭС) на основе неинвазивных ультразвуковых допплеровских методик, может стать одним из способов ранней верификации синдрома взаимного отягощения (СВО — когнитивных нарушений и признаков травматического синдрома жировой эмболии), способствуя модификации травматологических техник, рациональному выбору методов лечения и восстановления пациентов после сочетанной (автодорожной) травмы в интра- и послеоперационном периодах, улучшая прогнозы и результаты лечения.
Литература:
- Агаджанян В. В., Кравцов С. А. Политравма, пути развития (терминология) //Политравма. 2015. No 2. С. 6–13
- Абакумов М. М., Богопольский П. М. Damagecontrol: Что нового? // Хирургия. 2009. No11. С. 56–62.
- Андронникова О. О., Забродин Ю. М. Посттравматическая и психопатологическая симптоматика личности с виктимной идентичностью, пережившей автомобильную аварию. Клиническая и специальная психология 2021. Том 10. No 1. С. 80–99.
- Баранов В. А., Баранова Н. А., Воронкин Р. Г. Использование метода билатерального мониторирования кровотока в среднемозговых артериях с микроэмболодетенцией с целью ранней верификации синдрома жировой эмболии при поли травмах // Молодой ученый. 2025. № 31 (582), С.19–21
- Борисов, М. Б. Синдром жировой эмболии при сочетанных травмах. Прогнозирование, профилактика, диагностика, лечение: автореф. дис. канд. мед. наук: 14.00.27 / Борисов Максим Борисович. — Санкт-Петербург, 2001–24 с.
- Бочаров С. Н., Лебедь М. Л., Кирпиченко М. Г. Новый взгляд на патогенез синдрома жировой эмболии // Политравм. — 2016. — № 4.
- Габдуллин, М. М. Ранняя диагностики и лечение синдрома жировой эмболии у пациентов с тяжелой травмой нижних конечностей: дис. канд. мед. наук: 14.01.15 / Габдуллин Марат Мансурович. — Казань, 2020–151 с.
- Захаров В. В. Дроздова Е. А. Когнитивные нарушения у больных с черепно-мозговой травмой //Неврология, нейропсихиатрия, психосоматика. 2013. С. 88–93.
- Клинические рекомендации — Посттравматическое стрессовое расстройство — 2023–2024–2025 (28.02.2023) — Утверждено Минздравом РФ, с. 117
- Колесников, В. В., Рахимов, Б. М., Кирсанов, А. Н., & Бормотов, А. В. Жировая эмболия посттравматического периода //Тольяттинский медицинский консилиум. — 2018. — No. S1. — С. 11–23.
- Назарова, Е. О. Психоневрологический статус у пациентов с сочетанной травмой (обзорная статья). / Е. О. Назарова, С. М. Карпов, А. Э. Апагуни // Международный журнал экспериментального образования. — 2014 — No1. — С. 83–85.
- Назарова Е. О., Карпов С. М., Апагуни А. Э., Вышлова И. А. Современный взгляд на патогенетические механизмы травматической болезни при политравме // Вестник новых медицинских технологий. Электронное издание. 2018. No1. Публикация 7–1. URL: http://www.medtsu.tula.ru/VNMT/Bulletin/E2018–1/7–1.pdf. DOI: 10.24411/2075–4094–2018–15688.
- Паневин А. И. Стулин И. Д., Ярыгин Н. В., Садулаева А. Ш. Определение предикторов ближайших исходов боевых сочетанных травм с поражением головного мозга // Медицина критических состояний. 2009. Т. 4, No 4. С. 3–7. с.
- Семке В. Я., Ветлугина Т. П., Невидимова Т. И., Иванова С. А., Бохан H. A. Клиническая психонейроиммунология. Томск: «РАСКО», 2013. с.300
- Fukumoto L. E., Fukumoto K. D. Fat Embolism Syndrome //Nursing Clinics. — 2018. — Т. 53. — No. 3. — С. 335–347.
- Graziani A., Moretti C. C., Cappa F. M. Fat embolism syndrome: chest CT findings //Jornal Brasileiro de Pneumologia. — 2018. — Т. 44. — No. 3. — С. 244–244.
- Kuhne C. A. A.G. Polytrauma DGU Trauma centers in Germany: Status report // Unfallchirurg. 2009.No109(5). Р. 357–366.
- Lee J. C. Damage-control laparotimy // Curr. Opin. Crit. Care. 2006. No12(4). Р. 346–350.
- Psychometric properties of questionnaires evaluating health-related quality of life and functional status in polytrauma patients with lower extremity injury / Jansen L. [et al.] // J. Trauma Manag. Outcomes. 2010.Vol. 28, No 4. Р. 7.
- Zhibin Z., Peng S., Fang C. Fat embolism following a liposuction procedure //Neurology India. — 2018. — Т. 66. — No. 4. — С. 1206–1207.

