Введение
Иммунохроматографический анализ (ИХА) — качественный метод, который позволяет выявить наличие или отсутствие определенных веществ (аналитов) в биологических жидкостях — крови, слюне, моче, носовой слизи. Данный метод не требует специального оборудования, кроме тест-полосок и средств для взятия пробы, а результат можно получить всего через несколько минут. ИХА основан на методах тонкослойной хроматографии (разделение компонентов смеси при перемещении их с разной скоростью в системе несмешивающихся и движущихся относительно друг друга фаз) и иммунохимических реакциях (взаимодействие антиген-антитело).
ИХА широко используется в медицинской диагностике, создании банков плазмы и крови, судебной медицине, терапевтическом и экологическом мониторинге, при анализе продуктов питания (мясо, рыба), проверке здоровья животных. Может обозначаться как метод сухой иммунохимии, стрип-тест, QuikStrip cassette, QuikStrip dipstick, экспресс-тест или экспресс анализ. Чаще всего для анализа исполюзуют тест-полоски — пример твердофазного иммуноферментного анализа (ИХА).
- Строение тест-полоски.
Тест-полоска представляет собой многослойную структуру, каждый слой которой выполняет свою определенную функцию:
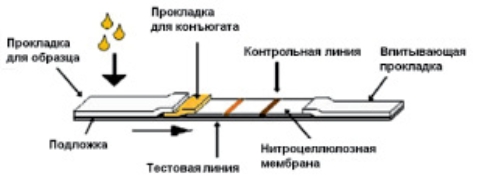
Пластиковая подложка с клеевой основой — служит фундаментом, на нее наклеены все компоненты фильтра
Слой для внесения образца — изготавливается из целлюлозы и/или стекловолокна, служит для внесения образца биологической жидкости и дальнейшего его перемещения к остальным частям тест-полоски. Данный элемент обеспечивает равномерное распределение образца и его предварительную обработку для отделения лишних компонентов, коррекции pH и т. д.
Слой с конъюгатом — на специальный фильтр нанесены молекулы меченого конъюгата для распознавания аналит-конъюгат (антигены или антитела, конъюгированные с цветной меткой; в качестве цветной метки используют флуоресцетнные или латексные частицы, наночастицы коллоидного золота). Материал фильтра обеспечивает быстрое высвобождение конъюгата при контакте с жидкостью и поддержание стабильности конъюгата на протяжении всего срока годности тест-полоски. А ковалентная связь между молекулами метки
Хроматографическая мембрана из нитроцеллюлозы — на нее нанесены реагенты (антигены или антитела) в виде контрольной и тестовой линий (зоны захвата иммунных комплексов). Мембрана обеспечивает хорошее связывание с белковыми молекулами, минимизируя неспецифическую адсорбцию. Это важно для специфичности и высокой чувствительности анализа.
Адсорбирующий слой (впитывающая прокладка) — впитывает дошедшую до нее жидкость, поддерживая продвижение жидкости вдоль мембраны и предотвращая ее обратный ток.
- Методика создания тест-полосок.
Процесс создания тест-полосок — это сложный и многоэтапный процесс, требующий тщательного контроля на каждом этапе:
- Подбор материалов: первый шаг — выбор оптимальных материалов для производства тест-полосок, а также подбор антител и антигенов, специфичных к определяемому аналиту.
- Изготовление хроматографической мембраны из нитроцеллюлозы.
Для нанесения белков используют контактные или бесконтактные диспенсерные системы, затем блокируют тест-полоски для контроля и стабилизации скорости потока и предотвращения неспецифических взаимодействий. Аналитическая мембрана не должна дестабилизировать связанные белки на тестовой и контрольной линиях в течение всего срока годности продукта или изменять характеристики потока в этот период. Блокировка обычно проводится путем помещения мембран в раствор, содержащий белки, поверхностно-активные вещества или полимеры.
Свойства, которыми должна обладать мембрана — гидрофильность, способность связывать белки, пористость.
- Подбор оптимальных концентраций и изготовление реагентов с цветной меткой, их нанесение на слой с конъюгатом.
Конъюгат можно наносить двумя способами:
– Сначала осуществляется предобработка мембраны путем внесения мембраны в водный раствор белков, поверхностно-активных веществ(ПАВ) и полимеров с последующей сушкой. После этого предобработанная мембрана вносится в раствор конъюгата.
– Конъюгат наносится с помощью количественного бесконтактного диспенсера.
- Подбор дополнительных реагентов для предобработки компонентов тест-полоски, чтобы улучшить свойства потока и лучшую чувствительность теста.
- Сборка всех компонентов на пластиковой подложке: тщательная сборка всех слоев тест-полоски на пластиковой подложке.
- Оптимизация условий проведения анализа реальных образцов: подбор оптимальных условий для анализа реальных образцов, чтобы обеспечить максимальную точность и надежность результатов.
- Изучение стабильности тест-системы: исследование стабильности тест-системы и выбор оптимальных условий хранения и упаковки для увеличения срока годности тестов.
- Нарезка и упаковка: выбор условий хранения и упаковки для увеличения срока хранения тестов. Нарезка собранных листов на отдельные тест-полоски, которые могут быть помещены в пластиковые кассеты.
- Индивидуальная упаковка: упаковка в индивидуальные герметичные пакеты.
- Методы иммунохроматографического анализа.
Существует несколько вариантов иммунохроматографического анализа, каждый из которых имеет свои особенности и применяется для решения определенных задач:
1) Конкурентный иммуноанализ.
Основан на конкуренции между исследуемым и меченым антигенами за связывание с антителами. Чем больше антигена в исходном растворе, тем меньше репортерного антигена свяжется с антигеном раствора.
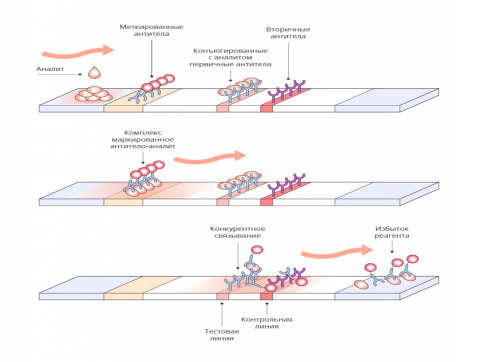
Раствор с целевым аналитом наносится на слой для внесения образца, жидкость доходит до слоя с конъюгатом. Меченые Ат гидратируются, активируются, захватывают аналит и передвигаются дальше с током жидкости к тестовой линии. На тестовой линии зафиксирован Аг (аналит), который мог бы связаться с мечеными Ат, но они уже заняты конкурентом — связавшимся с ними аналитом из образца. Низкомолекулярные соединения обычно имеют одну антигенную детерминанту, соответственно, антитела имеют один центр связывания с Аг, который уже занят аналитом. Реакция происходит, когда ток жидкости доходит до контрольной линии. Она содержит зафиксированные вторичные Ат, способные связываться с мечеными Ат, при этом образуется окрашенная контрольная линия. В результате, отсутствие окрашенной полосы в контрольной зоне свидетельствует о том, что концентрация определяемого вещества в исследуемом образце превышает его пороговое значение для данного теста.
При отсутствии анализируемого вещества в образце конъюгат Ат-метка связывается с конъюгатом Аг:белок-носитель, иммобилизованным в зоне тестовой линии. Несвязавшийся конъюгат Ат-метка попадает в зону контрольной линии и связывается там с антивидовыми антителами. Таким образом, наличие двух окрашенных линий (тестовой и контрольной) является отрицательным результатом анализа. Формат конкурентного ИХА используется для выявления низкомолекулярных соединений, в том числе метаболитов наркотических соединений в моче, жидкости ротовой полости, экстрактах тканей.
2) Неконкурентный, гетерогенный («сэндвич») анализ.
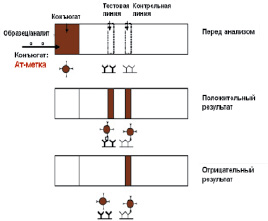
В этом методе используется конъюгат специфических антител с цветной меткой (в случае визуальной оценки результата), нанесенный на мембрану для конъюгата (наночастицы инертных металлов, флуоресцентные красители). На тестовой линии иммобилизованы антитела, специфические к данному аналиту, а на контрольной линии — антивидовые антитела, специфические к первичным антителам. При нанесении образца, содержащего анализируемое вещество, на мембране с конъюгатом происходит связывание аналита с конъюгатом Ат-метка. Затем иммунный комплекс попадает в тестовую зону, где он связывается со специфическими антителами, образуя «сэндвич» Ат-Аг-Ат-метка. избыток несвязавшегося конъюгата связывается с антивидовыми антителами на контрольной линии. Таким образом, выявление 2-х линий на тест-полоске является положительным результатом теста. При отсутствии аналита в образце конъюгат связывается с антивидовыми антителами только на контрольной линии, образуя одну линию на тест-полоске.
Есть другая модификация классического сэндвич-метода — принцип двойного антигена, или двухсайтовый метод. Он используется для выявления антител в образце. При этом один антиген нанесен на мембрану, а другой, конъюгированный с цветной меткой — находится на слое для конъюгата.
Используется для выявления высокомолекулярных соединений — вирусов, гормонов (тесты на беременность), возбудителей инфекционных заболеваний. Для образования «сэндвича» Ат-Аг-Ат антиген должен иметь две или более антигенные детерминанты.
3) Формат мультикомплексного обнаружения.
Этот формат применяется для идентификации более чем одного целевого аналита. Анализ проводится на полоске, на которой количество тестовых линий соответствует числу аналитов. Очень важно иметь возможность выявлять несколько аналитов в одинаковых условиях. Например, можно выявить одновременно наличие вирусов гриппа А и В в носоглоточных выделениях, ротавируса и аденовируса в кале.
- Вирусы, которые можно выявить путем ИХА
Иммунохроматографический анализ позволяет выявлять как сами вирусные частицы, так и антитела к ним, вырабатываемые организмом в ответ на инфекцию. Так, разработаны тест-полоски на такие вирусы, как ВИЧ, вирус гепатита В (на антитела и антигены), вирус гепатита А, ротавирус, аденовирусы, гриппы А и В, вирус Эпштейна-Барра (вызывает инфекционный мононуклеоз), респираторный синцитиальный вирус (РСВ).
Вирусы можно обнаруживать в крови, носоглоточных выделениях (COVID-19, вирусы гриппа), кале (ротавирус, аденовирус, РСВ). Вирус Эпштейна-Барра или антитела к нему можно обнаружить в крови, сыворотке, плазме или слюне.
Заключение
Иммунохроматографический анализ — это доступная и широко распространенная технология, применимая даже в домашних условиях. Она позволяет оперативно выявлять различные заболевания, связанные с наличием в организме определенных веществ или возбудителей. Визуальная оценка результата с помощью тест-полосок делает диагностику более доступной и позволяет проводить скрининг заболеваний в широких популяциях. Однако, при наличии времени, предпочтительнее использовать стандартный ПЦР-анализ, поскольку он обеспечивает более точное определение наличия определенного вещества и возможность анализа нескольких веществ одновременно.
Литература:
- Р. Шмид. Наглядная биотехнология и генетическая инженерия. С.158–159, 2020
- https://monographies.ru/en/book/section?id=9929
- https://www.vechnayamolodost.ru/articles/biomedicin/immunohromatografiya_ekspress_diagnostika_v_sakvoyazhe_semeynogo_doktora/
- https://besure.ru/blog/interesnye-stati/rukovodstvo-po-immunokhromatografii/
- Hubert Demorat, Amanda Lopes, Dorothée Chopin, Véronique Delcey, Philippe Clevenbergh, Guy Simoneau, John Evans, Stéphane Mouly, Jean-François Bergmann, Pierre Sellier. Acceptability and feasibility of HIV testing in general medicine by ELISA or rapid test from finger-stick whole blood https://pubmed.ncbi.nlm.nih.gov/29478794/
- Серебренникова К. В. Высокочувствительные экспресс- методы латерального проточного иммуноанализа биомаркеров для целей медицинской диагностики
- R Gauthier, J-M Livrozet, F Prevoteau du Clary, O Taulera, S Bouée, J-P Aubert, A M Py, J M Peter, C Majerholc, S Héber Suffrin, C Compagnon, A Wajsbrot Feasibility and acceptability of rapid HIV test screening (DEPIVIH) by French family physicians
- https://rosstip.ru/patents/173861-sposob-izgotovleniya-test-polosok-s-reaktivami
- https://sulda.ru/services/detail/309/
- Elena A Zvereva, Olga D Hendrickson, Boris B Dzantiev, Anatoly V Zherdev Comparison of competitive and sandwich immunochromatographic analysis in the authentication of chicken in meat products https://pubmed.ncbi.nlm.nih.gov/38382834/

