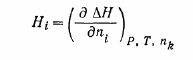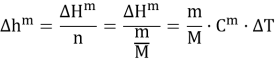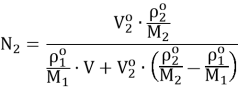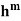Теплоты смешения являются фундаментальными энергетическими характеристиками растворов, отражающими энергии межмолекулярных взаимодействий в жидкой фазе. Исследование теплот смешения представляет собой эффективный метод физико-химического анализа жидких систем, позволяющий сделать выводы о характере молекулярных процессов, сопровождающих образование раствора, на основе анализа зависимости теплот смешения от концентрации и температуры. В данной работе представлены результаты экспериментального исследования теплот смешения системы вода-уксусная кислота с использованием калориметрического метода.
Ключевые слова: теплота смешения, энтальпия смешения, калориметрия, термохимия, растворы, уксусная кислота, вода.
Теоретические основы
Теплотой смешения называется теплота, поглощаемая или выделяемая системой при смешении n1 моль первого компонента и n2 моль второго компонента в условиях постоянства температуры и давления. Интегральная мольная теплота смешения представляет собой величину, отнесенную к 1 моль образующегося раствора.
Парциальные мольные теплоты (энтальпии) смешения H i определяются соотношением [1]
|
|
(1) |
где Δ H — энтальпия смешения, n i — количество вещества компонента.
Существуют различные методы определения теплот смешения:
— Непосредственные калориметрические измерения.
— Расчет на основании данных о равновесии жидкость-пар при разных температурах (или других данных, позволяющих определить зависимость коэффициентов активности компонентов раствора от температуры).
— Расчет как разности между величинами теплот испарения растворов и чистых компонентов [1].
Калориметрический метод является наиболее распространенным и точным.
Мольная теплота смешения жидкости (или мольная энтальпия) рассчитывается по формуле:
|
|
(2) |
где n — число молей, m — масса вещества, M — мольная масса вещества, C m — теплоемкость калориметра, Δ T — изменение температуры.
Мольная масса смеси определяется по формуле:
M = M 1 N 1 + M 2 N 2 , (3)
где M 1 и M 2 — мольные массы компонентов, N 1 и N 2 — мольные доли компонентов.
Мольная доля компонента в растворе рассчитывается по формуле:
|
|
(4) |
где ρ1° и ρ2° — плотности масс чистых 1-го и 2-го компонентов, V и V2o — отмеряемые объемы компонентов [4].
Материалы и методы
В работе использовался калориметр с изотермической воздушной оболочкой (рисунок 1), позволяющей исключить теплообмен калориметра с окружающей средой. Использованный калориметр является калориметром открытого типа, в котором давление во время опыта остается постоянным [2]
![Изометрический калориметр [2]](https://articles-static-cdn.moluch.org/articles/j/126108/images/126108-4.png)
Рис. 1. Изометрический калориметр [2]
Реактивы и оборудование: полипропиленовый стакан, мешалка, термометр Бекмана, дистиллированная вода, уксусная кислота, секундомер, весы.
Эксперимент проводился следующим образом:
- В калориметрический стакан заливали 0,15 л дистиллированной воды.
- Помещали в стакан мешалку и термометр Бекмана, включали мешалку и производили 6–7 замеров температуры с интервалом в 1 минуту.
- После установления равномерного изменения температуры (не более 0,04 град/мин) на 6–7 минуте от начала опыта, медленно вливали уксусную кислоту в объеме 0,075 л, 0,080 л, 0,070 л, соответственно для каждого опыта.
- Продолжали измерение температуры до установления продолжительного равномерного изменения температуры (5–11 замеров).
- По полученным данным строили температурную кривую калориметрического опыта.
![Температурная кривая калориметрического опыта [2]](https://articles-static-cdn.moluch.org/articles/j/126108/images/126108-5.png)
Рис. 2. Температурная кривая калориметрического опыта [2]
Для определения Δ T использовали графический метод. Продолжали отрезки AB и DE до пересечения с перпендикуляром KK’, восстановленным из середины отрезка B’D’, который отражает продолжительность главного процесса. Δ T =KK’.
Результаты и обсуждение
В таблице 1 приведены исходные данные для расчетов теплоемкости калориметра.
Таблица 1
Исходные данные приборов
|
Расчеты калориметра, учитываемые в теплообмене |
Раствор |
Соприкасающаяся с раствором часть | ||
|
стакана |
мешалки |
термометра | ||
|
Объем или масса |
150 мл 153 г |
98,588 г |
0,001 дм 3 |
0,00002 м 3 |
|
Удельная теплоемкость |
4187 Дж/кг⋅К |
823,5 Дж/кг⋅К |
3713 Дж/дм 3 ⋅К |
1,923 ⋅ 10 6 Дж/м 3 ⋅К |
|
Теплоемкость части калориметра, Дж/К |
640,611 |
81,18 |
3,713 |
3,846 |
Таблица 2
Теоретические исходные данные
|
Вещество |
Температура, К |
Плотность, кг/см 3 |
Молярная масса, кг/моль |
|
H 2 O |
298 |
996,9 |
0,018 |
|
Уксусная кислота |
298 |
1044,15 |
0,06005 |
Таблица 3
Результаты расчетов мольной теплоты смешения жидкости
|
V H2O , мл |
V Кислоты , мл |
ΔT, °С |
N2 |
Δhm, Дж/моль (общая) |
Δhm, Дж/моль (компонента) |
|
75 |
75 |
1,15 |
0,239 |
153,7 |
300,47 |
|
80 |
70 |
2,4 |
0,264 |
338,2 |
610 |
|
70 |
80 |
1,05 |
0,216 |
137,8 |
238,7 |
Теоретические значения мольных теплот смешения системы вода-уксусная кислота при T = 297 К, взятые из работы [4], приведены в таблице 4.
Таблица 4
Теоретические значения при T = 297 К
|
N 2 |
Δ
|
|
0,06 |
-19,7 |
|
0,10 |
0 |
|
0,21 |
125,5 |
|
0,33 |
230,1 |
|
0,43 |
282,4 |
|
0,46 |
301,2 |
|
0,54 |
322,2 |
|
0,67 |
338,9 |
|
0,71 |
343,3 |
|
0,78 |
326,4 |
|
0,84 |
288,7 |
|
0,89 |
238,5 |
На рисунке 3 сопоставлены экспериментальные данные с теоретической зависимостью Δhm от N2.
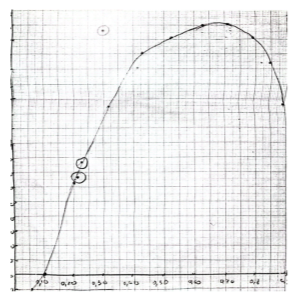
Рис. 3. Сопоставление экспериментальных данных с теоретическими
Сопоставление показывает удовлетворительное согласие экспериментальных данных с теоретической кривой. Полученные значения Δhm имеют положительные значения, что свидетельствует об эндотермическом характере процесса смешения, то есть о преобладании энергий разрыва межмолекулярных связей по сравнению с энергиями образования новых связей в растворе.
Литература:
- Белоусов В. П., Морачевский А. Г. Теплоты смешения жидкостей. — Л.: “Химия” Ленинградское отделение, 1970. — 256 с.
- Виноградова Т. В. Определение интегральной мольной теплоты растворения соли. — Екатеринбург: ФГАОУ ВПО “Уральский федеральный университет имени первого Президента России Б. Н. Ельцина”, 2014. — 18 с.
- Мищенко К. П., Равделя А. А. Практические работы по физической химии. — 2 изд. — Санкт Петербург: Государственное научно-техническое издательство химической литературы, 1961. — 256 с.
- Степановских Е. И., Уломский Е. Н., Русинова Л. И. Теплоты смешения жидкости (справочные материалы). — Екатеринбург: Издательство УГТУ-УПИ, 2001. — 28 с.